~細胞の「設計」・「編集」・「評価」のプロセスの高速循環を達成し、未来の創薬・細胞医薬をカタチにする実験拠点~
Life Science and Technology, Healthcare
「細胞デザイン拠点」構想は、 現在、東京工業大学 科学技術創成研究院 細胞制御工学研究センターの「加納ふみ准教授研究室(細胞編集工学研究室)」と、同研究院の「マルチモーダル細胞解析協働研究拠点(拠点長・村田昌之特任教授)」を中心に進められています。
細胞は、創薬・細胞医薬や物質生産のマテリアル・ツールとして、急速にその需要と品質管理の必要性が増加しています。しかし、実際は細胞ユーザーである様々な大学・研究機関や企業の研究室が利用目的に応じて個別に対応・管理し利用しているのが現状です。この様な孤立した知識と技術利用環境にある細胞ユーザーの現状を改善し、細胞に関する最先端の基礎研究成果の社会への新しい導出システムを構築するため、産官学のシームレスな連携体制を基に、 細胞を設計し、編集・操作し、評価する、細胞デザイン拠点を創成します。そこでは、「細胞」を利用するあらゆる学問領域や産業界に、細胞を理解し利用する「知識と技術そして人材」を提供することで、細胞の新しい「価値」を創成する研究・開発・教育の実験拠点を目指します(図1参照)。
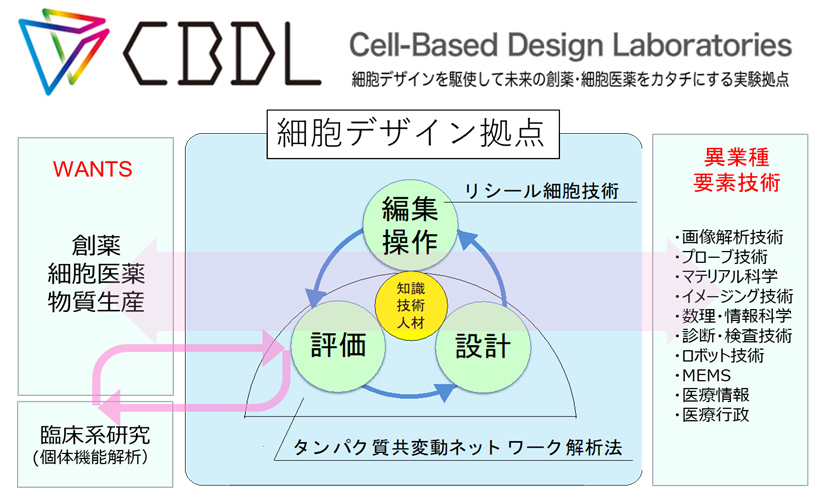
拠点では目的の細胞の機能やその制御・(疾患やウイルスなどによる)攪乱機構を「タンパク質ネットワーク」の頑強性とその攪乱として理解し、その知見を基に、細胞を様々な研究・産業に利用できるように「設計」し、設計に基づいて細胞を「編集・操作」する為の知識・技術・バイオマテリアルを創成します。そして設計に基づいて、それら編集・操作の効果を「評価」して、ユーザーのWANTSを満たす最適な細胞・細菌・バイオマテリアルができるまで、この「設計→編集・操作→評価」のプロセスを高速に循環させる体制を構築します。
拠点では、この拠点活動の駆動力となる2つの重要な基盤技術を持っています。
タンパク質共変動ネットワーク解析法
~「細胞状態」を活写する、世界初・日本発の細胞「設計・評価」システム~
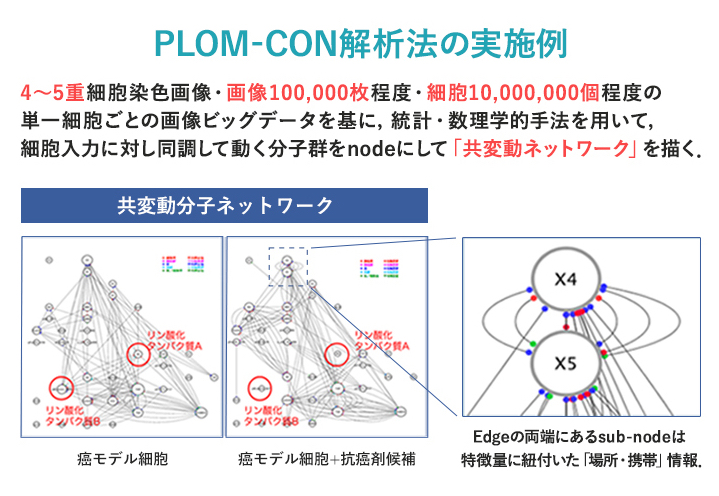
一つ目は、最先端の細胞イメージング技術を基にして、分子と形態・空間情報を統合して実際の細胞内で働くタンパク質ネットワークを表す「PLOM-CON(Protein Localization and Modification-based Covariation Network)解析技術」です(参考文献1)。この技術は、世界に蓄積した膨大な分子情報に、細胞染色画像から得られる「カタチ」を新しいパラメーターとして加えることで、新しい細胞機能・薬剤主作用や副作用点を同定する世界初・日本発の細胞「設計・評価」システムです(図2)。
一般に知られるタンパク質ネットワークはシグナル伝達経路における上流―下流の関係や実験的に見つけられたタンパク質間相互作用をもとに作成されています。これは様々な研究者、細胞種、実験条件で得られた文献から網羅的に集めたタンパク質間相互作用を一つのネットワークにまとめた一種の白地図です。理想の細胞内の仮想ネットワークです。よって全ての情報が辞典のように網羅されていますが、逆に特定の条件下の特定の細胞ではどのシグナル伝達経路が動いているかはわかりません。創薬・細胞医薬や新しい機能賦活化細胞作成には、この特定の条件下で機能するタンパク質ネットワークを抽出し利用することが重要です。

PLOM-CON解析法は、まさに特定の刺激が入力された細胞内で生起するタンパク質群の「量・質(リン酸化などの翻訳後修飾)・細胞内局在」の時間的同調性を、蛍光抗体法等による細胞染色画像のビッグデータから定量的に求めることによって、「活きた」タンパク質ネットワーク(=共変動ネットワークと言います)を精度良く得ることができます。正常と病態、または病態に薬剤処理した細胞間では、それぞれの共変動ネットワークの形の微弱な違いが表れます。この形の違いを、ネットワークの次数中心性、媒介中心性、近接中心性などを調べることでハブ(ボトルネック)となるタンパク質を推定し、病態発現や薬剤により細胞の特定の機能攪乱や改善に関わるタンパク質ネットワークの要素(バイオマーカー)がわかります(図3)。その情報を駆使して疾患のバイオマーカーや薬剤の主作用・副作用に関わる「形態情報を含んだ分子情報」が数理・統計学的に抽出できます。この共変動ネットワークは、様々な形態・分子情報の定量的な時間同調性の強弱だけを指標に作られます。その手法原理の特徴を最大限に活かすことによって、様々なオミクス解析による分子情報を細胞内のタンパク質情報と繋ぐことで、多次元生物情報を利用した精密医療支援を目的とした創薬・細胞医薬支援プラットフォーム構築を進めています。
リシール細胞技術
~特定の疾患をモデル化できる「細胞型試験管」、世界に類を見ない細胞「編集」システム~
二つ目は、特定の細胞・組織の細胞質を標的細胞の細胞質と交換することにより、標的細胞内の環境を同調変換・操作できる「セミインタクト細胞リシール法(以下、リシール細胞技術)」という世界に類を見ない細胞「編集」システムです(参考文献2, 3)。
セミインタクト細胞とは、連鎖球菌の酸素感受性毒素ストレプトリシンO(SLO)により、細胞膜を部分的に透過性にして細胞質(以下、サイトゾルと言います)を流出させた細胞です(図2)。セミインタクト細胞では、オルガネラや細胞骨格の構造やそれらの空間的配置が保持されているため、導入されたサイトゾルやタンパク質、膜不透過性の低分子化合物や中分子(核酸・ペプチドなど)の機能やその機能制御機構が最適に再現できる細胞内環境が整っています。この20年間に、我々は別途調製した様々な細胞状態のサイトゾルをセミインタクト細胞に添加・導入することで、導入されたサイトゾル依存的な様々な生命現象を光学顕微鏡下の単一細胞内で可視化し分析的に再構成することにより、生命現象を駆動し制御するタンパク質の機能・動態解析を行ってきました。例えば、間期や細胞分裂期(M期)のような細胞周期を同調させたサイトゾルを導入したセミインタクト細胞系を用い、細胞周期依存的な様々なオルガネラ形態変化や各種オルガネラ間の膜小胞輸送制御分子群の解析を行ってきました(参考文献 3, 5, 6)。
サイトゾル導入後のセミインタクト細胞はCa2+依存的にリシール(再封入)し,細胞分裂・増殖可能な「リシール細胞」となります(図4)。
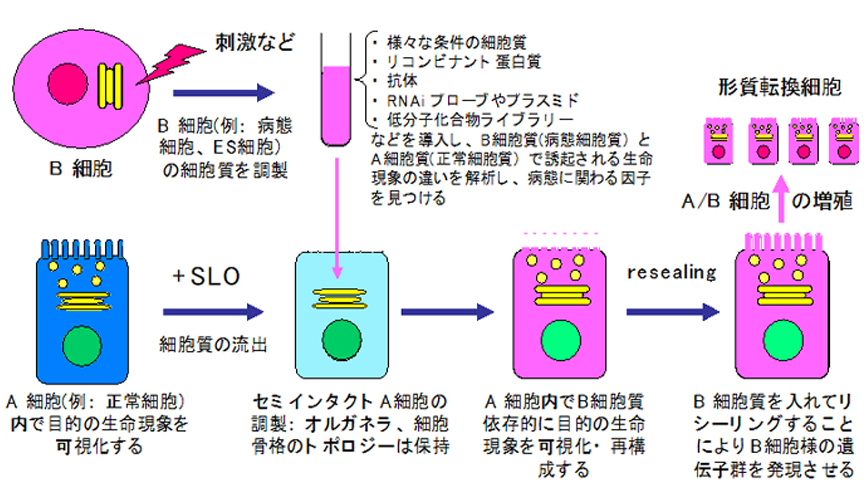
つまり、リシール細胞は、細胞膜・オルガネラ・細胞骨格が作る構造的環境を保持したままで構成要素的環境(サイトゾル)を交換・操作できる「細胞型試験管」となります。例えば、疾患モデル動物(マウスなど)の臓器から調製した「病態サイトゾル」を導入して細胞内環境を病態環境にミミックさせた「病態モデル細胞」を、1〜107個のオーダーで作成することも可能です。
タンパク質の動態や機能、薬剤の薬効や作用機序解析は、「正常または病態環境」を保持した細胞内で実施されることでその精度を飛躍的に向上させると考えられます。しかし、培養細胞の多くはがん化した細胞であり目的に適った特定の疾患フェノタイプを示す培養細胞を見つけるのは非常に困難です。また患者の病態組織などから得られる初代培養細胞の寿命は短く、しかも不均一性(様々な病態進行過程の細胞が混在している)であるため、このような細胞集団を用いたタンパク質機能解析や薬剤作用機序解析は現実的には困難を極めます。我々の「正常または病態モデル細胞」を駆使することで、「病態細胞環境」での様々な生命現象を分析的に再構成することが可能となります。また、様々な疾患バイオマーカータンパク質の細胞内動態や機能変化・撹乱・正常化を単一細胞レベルから107個のオーダーのモデル細胞を使って検出することができるため、最先端の細胞イメージング技術を駆使したシングルセル解析〜最新の多階層オミクス解析を駆使した多次元の生命情報を利用して薬剤の薬効やその作用機序をより精密に解析・同定・検証できます(参考文献 7, 8, 9)。
この様にリシール細胞技術は、多様な細胞状態のサイトゾルを交換して「正常または病態モデル細胞」を作成し、その細胞質内や核内ニッチを編集した細胞のフェノタイプ解析から疾患バイオマーカーや薬剤の作用機序解析に有効に利用できることに特徴があります。つまり、最近、ゲノム編集技術をもとに、細胞へのgenotype導入による新しいphenotype実現・解析が盛んに進められていますが、われわれのリシール細胞技術は、phenotype導入による標的細胞のdramatype実現(様々な細胞応答に伴う細胞状態変化・編集)を可能にする世界で唯一の安全で汎用的な「細胞編集」技術です。
一方、リシール細胞法は、膜不透過性物質の簡便な細胞内導入(cytosolic delivery)技術としても利用できます。最近、我々はSLOと同種のコレステロール依存性の膜穿孔活性を持つLLO毒素を用いて、新規のリシール細胞法(LLO型リシール細胞法)を開発しました。この手法の特徴は、SLO型リシール法に比べて穿孔の度合いが小さいため、〜10kDa以下の大きさの膜不透過性分子しか細胞内導入に適しています。しかし、細胞膜からのサイトゾル漏洩(細胞膜障害)が殆どないこと、リシール操作にSLO型では必要不可欠の「サイトゾル」が不要でありCa2++のみでリシールが完了するため、核酸やペプチドなどの中分子医薬品(多くは〜10kDa以下の大きさの膜不透過性分子)の細胞内での機能検定に汎用的に利用でき、かつハイスループット性も十分期待できる技術です(文献)。LLO型リシール法とSLO型リシール法を適宜使い分けたり併用することで、今後ますます多様化する創薬モダリティーに対応した細胞内導入技術となってゆくと期待しています(参考文献10)。
最近の我々のリシール細胞技術の応用として注目されているのがエクソソーム研究への応用です。エクソソーム研究は疾患マーカー探索として、また、有効なDDS(薬物送達技術)としてもその応用研究が創薬・細胞医薬の分野で期待されている領域です。最近、我々はリシール細胞技術を用いてエクソソーム内腔へのmicroRNAや蛍光標識タンパク質の取り込み過程を可視化再構成できるシステムを構築しました(文献)。このシステムを用いることで、治療用物質を内包したエクソソームの培養細胞を利用した大量調製の可能性や、正常と病態モデル細胞から調製したエクソソームの性状解析から新たな疾患バイオマーカーの抽出・同定に期待されています(参考文献11)。
2つの基盤技術の融合による新しい創薬・細胞医薬プラットフォーム
~集合知による創薬手法のパラダイムシフト~
細胞デザイン拠点を中心に、東工大・加納ふみ研究室や東工大・マルチモーダル細胞解析協働研究拠点では、ここで紹介した2つの基盤技術を融合することで、精密医療、未病創薬、安全で新たな細胞医療のためのプラットフォーム構築を目指しています。正常または病態モデル細胞のフェノタイプの比較解析には、今までにも細胞イメージングを使ったローカリゾミクス、遺伝子発現変動を定量的に解析するトランスクリプトーム、代謝産物変化を指標にするメタボローム、エピジェネティックな遺伝子発現制御機構に注目するエピゲノム解析など多階層オミクス解析結果を最大限に利用してきました。今後は、それに加えて病態モデル細胞とPLOM-CON解析法を最適にカップルさせることで、正常と病態発現の細胞状態の微弱な「差異」を共変動ネットワークの形状から感度よく推定し、形態情報を含む新規分子情報をもとに今までとは全く質の異なるバイオマーカーを抽出・同定できるようになります。そして、同じ細胞システムを用いて実験的にその結果を検証することが可能となります。また、同じ細胞系と共変動ネットワークから得られた形態・分子情報を利用して、さらに薬効の高い薬剤や細胞編集操作をスクリーニングすることもできます。一方、PLOM-CON解析法はシングルセルレベルの分子や形態の定量的情報を基に成り立っている解析法のため、精密医療のためにますます必要性が増すシングルセル解析データとの親和性も強い解析法です。そこで、病態発現の超早期や進行過程そして未病状態におけるバイオマーカーを多次元の生物情報から抽出し実験的に検証することを得意とします。この様に、2つの基盤技術をカップルさせた新しい創薬・細胞医薬プラットフォーム作りには、2つの基盤技術の精密化、スピード化、スケール化のための様々な要素技術(ロボット化技術、コンピューテショナルイメージング、AI創薬など)や知識(AI創薬、数理・情報科学、ネットワーク解析学など)が必要不可欠です。加えて、最先端の多様な細胞イメージング技術や多階層オミクスとの早急な融合とそれから得られる膨大な情報を集積し管理し統合し,急速に変化する創薬・細胞医薬の課題にソリューションを出し続ける柔軟でイノベーティブな細胞デザインチームが必要不可欠です。東工大「細胞デザイン拠点」はそのための知識・技術の社会実装とそれを支える人材の育成のための研究・開発・教育の実験拠点を目指しています。
参考文献
- Noguchi,Y., Kano, F., Maiya, N., Iwamoto, C., Yamasaki, S., Otsubo, Y., Nakatsu, D., Kunishige, R., Murata, M. (2021) Microscopic image-based covariation network analysis for actin scaffold-modified insulin signaling. iScience. 10.1016/j.isci.2021.102724.
- Kunishige, R., Kano, F., Murata, M. (2019) The cell resealing technique for manipulating, visualizing, and elucidating molecular functions in living cells. Biochem. Biophys. Acta (General Subjects), doi: 10.1016/j.bbagen.2019.03.015.
- 村田昌之、加納ふみ (2018) セミインタクト細胞リシール技術の新展開:「再構成」から「細胞編集」まで、生化学、90巻4号、433-443.
- Kano, F., Takenaka, K., Yamamoto, A., Nagayama, K., Nishida, E. and Murata, M.(2000) MEK andCdc2 kinase are sequentially required for Golgi disassembly in MDCK cells by the mitotic Xenopus extracts. J.Cell Biol., 149: 357-368.
- Kano,F., Yamauchi,S., Yoshida,Y., Watanabe-Takahashi,M., Nishikawa,K., Nakamura,N., and Murata, M. (2009) Yip1A regulates the COPI-independent retrograde transport from the Golgi apparatus to the endoplasmic reticulum. J. Cell Sci. 122: 2218-2227.
- Matsuto, M., Kano, F., Murata, M. (2015) Reconstitution of the targeting of Rab6A to the Golgi apparatus in semi-intact HeLa cells: A role of BICD2 in stabilizing Rab6A on Golgi membranes and a concerted role of Rab6A/BICD2 interactions in Golgi-to-ER retrograde transport. Biochem. Biophys. Acta (Molecular Cell Research) , 1853 (10): 2592–2609. doi:10.1016/j.bbamcr.2015.05.005
- Kano, F., Nakatsu, D., Noguchi, Y., Yamamoto, A., Murata, M. (2012) A resealed-cell system for analyzingpathogenic intracellular evenys: Perturbation of endocytic pathways under diabetic conditions. PLoS ONE, 7(8):e44127. doi: 10.1371/journal.pone.0044127.
- Kano, F., Noguchi, Y., Murata, M. (2017) Establishment and phenotyping of disease model cells created by cell-resealing technique. Sci. Rep. 7, Article number: 15167. doi:10.1038/s41598-017-15443-0.
- Kano, F., Murata, M. (2019) Phosphatidylinositol-3-phosphate-mediated actin domain formation linked to DNA synthesis upon insulin treatment in rat hepatoma-derived H4IIEC3 cells. Biochem. Biophys. Acta (Molecular Cell Research), 1866(5):793-805. doi: 10.1016/j.bbamcr.2019.02.005.
- Murakami, M., Kano, F., Murata, M. (2018) LLO-mediated cell resealing system for analyzing intracellular activity of membrane-impermeable biopharmaceuticals of mid-sized molecular weight. Sci. Rep. 8, Article number: 1946. doi:10.1038/s41598-018-20482-2.
- Sonoda, Y., Kano , F., Murata, M. (2021) Applications of cell resealing to reconstitute microRNA loading to extracellular vesicles. Sci. Rep. 11, 11(1):2900. doi: 10.1038/s41598-021-82452-5.